
قسم الكيمياء الحيوية والبيولوجيا الجزيئية
في هذا العدد من المجلة البحثية، سنسلط الضوء على البحث الذي يجريه قسم الكيمياء الحيوية والبيولوجيا الجزيئية في معهد دسمان للسكري، بقيادة الدكتور جهاد أبو بكر.
تعرّف على الباحث
تعرّف على الباحثين القائمين على أبحاث معهد دسمان للسكري
تطبيقات علم الايبيجينيتكس في مرض السكري من النوع الثاني: يمكن لميثيل الحمض النووي الريبي تنظيم بيولوجيا الخلايا البشرية وإفراز الأنسولين
تاريخ النشر01/09/2019
إن تنظيم بيولوجيا الخلايا الجزيرية هو أمر بالغ الأهمية لاستتباب الجلوكوز. أظهرت دراسات عديدة أنه يتم التعبير عن وسطاء m6A (بروتين الكتابة والإلغاء والقراءة) في الخلايا الجزيرية البشرية لدى مجموعات المقارنة. ومع ذلك، أظهر تحليل خلايا جزيرية بشرية أنه يتم تنظيم العديد من مُعدِّلات m6A (مثل METTL3 وALKBH5 وYTHDF1) بالإنقاص في خلايا جزيرية كاملة في عينات المصاب بمرض السكري من النوع الثاني مقارنةً بغير المصاب به. وكشف المزيد من التحليل أن الخلايا بيتا هي التي تعبّر على وجه الخصوص عن المستويات المنخفضة من وسطاء m6A بسبب وجود مرض السكري من النوع الثاني.
ونظرت دراسة حديثة أجراها “دي جيسوس وآخرون” (De Jesus et al., 2019) في هذه الملاحظة ووضحت الآلية التي يمكن أن تتأثر بها مثيلة الحمض النووي الريبي في حالة السكري من النوع الثاني. قيّموا الاختلافات في التعبير الجيني على مستوى الخلية المفردة، لا سيّما خلايا بيتا في الخلايا الجزيرية لدى البشر المصابين وغير المصابين بمرض السكري. وأثبتوا أن جينات m6A تظهر اختلافات أكثر بكثير مقارنة بالجينات غير m6A، وضمن جينات m6A كان معامل الاختلاف أعلى لدى الأفراد المصابين بمرض السكري من النوع الثاني مقارنة بغير المصابين به. ومن المثير للاهتمام أنهم أثبتوا أن جينات المصابين بالسكري من النوع الثاني تشارك في تنظيم دورة الخلية، وإشارات المستقبلات، وإفراز الأنسولين، وتطور البنكرياس. بالإضافة إلى ذلك، تتواجد هذه الجينات “ناقصة الميثيل” ضمن العديد من المسارات المهمّة لبيولوجيا خلايا بيتا، وهي ترتبط بحدوث مرض السكري. من الأمثلة على هذه الجينات سكري الشباب الناضجين ومستقبلات الأنسولين (IR) / مستقبلات عامل النمو الشبيه بالأنسولين 1 (IGF1R). وعلى وجه الخصوص، يتأثر مسار الأنسولين / IGF1-AKT-PDX1 بشكل كبير بمثيلة الحمض النووي الريبوزي المنقوص الأكسجين في حالة السكري من النوع الثاني. في الواقع، من المعروف أن ضعف إشارات الأنسولين / IGF1-AKT وتنظيم PDX1 بالإنقاص يرتبط بالسكري من النوع الثاني. ومعاً، تشير بياناتهم إلى أن مثيلة الحمض النووي الريبوزي المنقوص الأكسجين لحالات نسخ معينة في الخلايا الجزيرية لدى مرضى السكري من النوع الثاني يؤدي إلى توقف دورة الخلية وضعف إفراز الأنسولين من خلال تنظيم مسار الأنسولين / IGF1-AKT-PDX1 بالإنقاص (الرسم البياني 5).
تمكّنوا من تأكيد النتائج التي توصلوا إليها باستخدام سلالة خلوية بيتا بشرية وتعطيل منظمات M6A الرئيسية (METTL3 أو METTL14) ثم إجراء تسلسل m6A و الحمض النووي الريبي. بالإضافة إلى ذلك، قاموا بتعطيل خلايا بيتا (M14KO) لفئران للتحقق من صحة النتائج التي توصلوا إليها في نظام الثدييات في الجسم الحي. لقد أظهروا أن هذا التعطيل قد يغيّر التعبير ومثيلة النسخ المشاركة في تنظيم دورة الخلية وإفراز الأنسولين (على سبيل المثال PDX1 و IGF1R).
أخيرًا، تقترح الدراسة أن الاستهداف العلاجي لمنظمات m6A بطريقة خاصة بالخلايا بيتا قد يكون فرصة جديدة لمواجهة انخفاض مستويات m6A في الخلايا الجزيرية لدى مرضى السكري من النوع الثاني ولتعزيز بقاء خلايا بيتا وأدائها لوظيفتها.
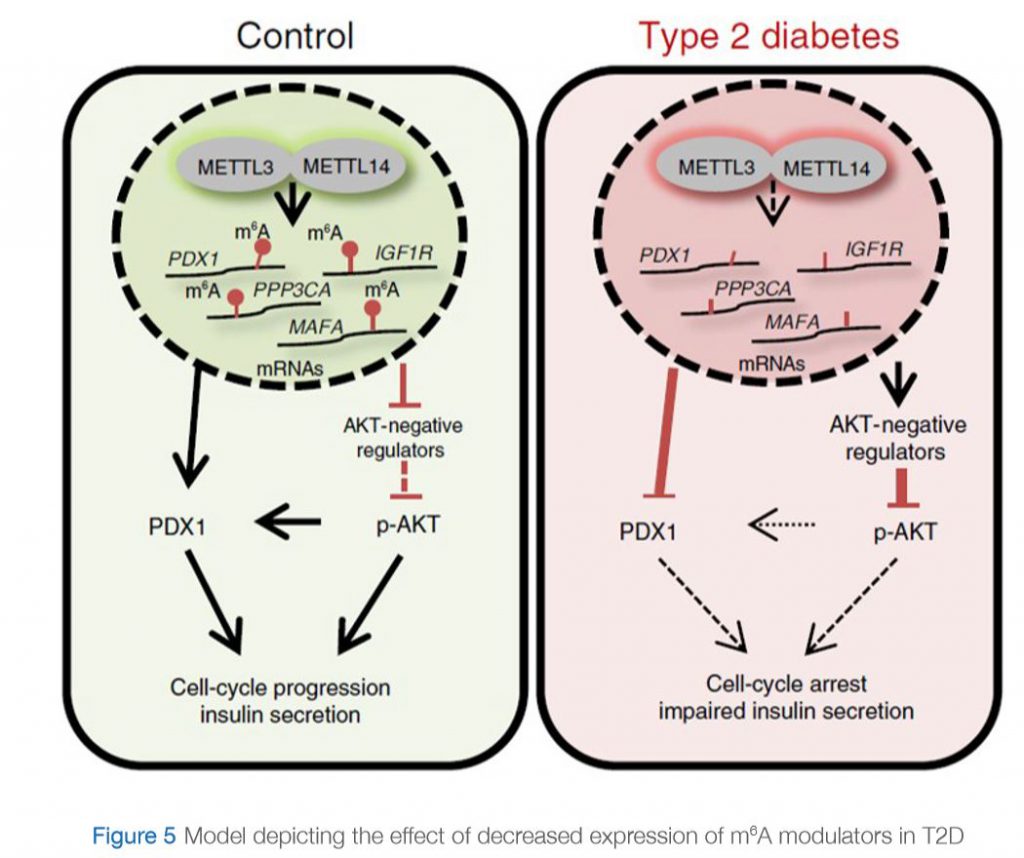
في حالة السيطرة: التعبير عن “بروتينات الكتابة” (METTL3 و METTL14) طبيعي. تتم ميثلة الجينات المشاركة في إشارات الأنسولين بشكل صحيح. ويتم تنشيط مسار pAKT وإنتاج بروتين PDX1، ما يؤدي إلى تقدّم دورة الخلية وإفراز الأنسولين.
في حالة مرض السكري من النوع الثاني: التعبير عن “بروتينات الكتابة” (METTL3 و METTL14) منخفض. الجينات المشاركة في إشارات الأنسولين هي ناقصة الميثيل (تفتقر إلى المثيلة). وينتج عن ذلك زيادة في التعبير عن منظمات AKT السلبية، ما يؤدي إلى انخفاض فسفرة AKT. يتم تنظيم تعبير PDX1 بالإنقاص. ويؤدي ذلك في النهاية إلى توقف الدورة الخلوية وضعف إفراز الأنسولين.
المراجع:
1. Abu-Farha, M., P. Cherian, I. Al-Khairi, R. Nizam, A. Alkandari, H. Arefanian, J. Tuomilehto, F. Al-Mulla and J. Abubaker (2019). “Reduced miR-181d level in obesity and its role in lipid metabolism via regulation of ANGPTL3.” Scientific Reports 9(1): 11866.
2. De Jesus, D. F., Z. Zhang, S. Kahraman, N. K. Brown, M. Chen, J. Hu, M. K. Gupta, C. He and R. N. Kulkarni (2019). “m6A mRNA methylation regulates human β-cell biology in physiological states and in type 2 diabetes.” Nature Metabolism 1(8): 765-774.
3. Dominissini, D. (2014). “Roadmap to the epitranscriptome.” Science 346(6214): 1192.
4. Yang, Y., P. J. Hsu, Y. S. Chen and Y. G. Yang (2018). “Dynamic transcriptomic m(6)A decoration: writers, erasers, readers and functions in RNA metabolism.” Cell Res 28(6): 616-624.


