قسم علم الأحياء الدقيقة والمناعة
في هذا العدد من المجلة البحثية، سنسلط الضوء على البحث الذي يجريه قسم علم الأحياء الدقيقة والمناعة في معهد دسمان للسكري، بقيادة الدكتور رشيد أحمد.
أبرز نتائج الأبحاث
اكتشف آخر الأبحاث التي يجريها معهد دسمان للسكري
العامل التنظيمي للإنترفيرون 3 (Irf3) هو منظم رئيسي للالتهابات الأيضية ومقاومة الأنسولين واضطرابات توازن الجلوكوز
تاريخ النشر01/06/2019
ترتبط السمنة / التغذية المفرطة بحالة من الالتهاب المزمن منخفض الدرجة، وتزيد آثاره الأيضية مع الاتجاه بشكل كبير من خطر الإصابة بمتلازمة أيضية، بما في ذلك مرض السكري من النوع 2 وأمراض القلب والأوعية الدموية ومرض الكبد الدهني والاعتلال العصبي. أصبح دور الالتهاب الأيضي في مرض السكري من النوع الثاني والأمراض المرتبطة به واضحًا الآن، على الرغم من أن المسارات التي تعزز وتحافظ على الالتهاب في السمنة لا تزال غير واضحة. ينبغي أن نعزز فهمنا للعوامل التي تشارك بشكل خاص في مرض السكري من النوع الثاني إذا كنا نأمل وقف المرض الأيضي وتجنب في الوقت نفسه التثبيط المناعي الكامل. ركزت المجموعات التي يقودها الدكتور رشيد أحمد هنا في معهد دسمان للسكري والبروفيسور إيفان روزين في كلية الطب بجامعة هارفرد على دور عامل النسخ IRF3 (العامل التنظيمي للإنترفيرون 3) في تعزيز السمنة ومقاومة الأنسولين والالتهابات. ومعًا أظهروا أن الافتقار إلى IRF3 في جميع الأنسجة لدى الفئران (على سبيل المثال تعطيل شامل لـ IRF3) زاد من تنشيط الدهون البنية، وعزز مقاومة السمنة، وحسّن القدرة على تحمّل الجلوكوز، وقلل من علامات الالتهاب المنتشرة والموضعية (الرسمان البيانيان 1 و 2 في كوماري وآخرون، 2016).
في العمل اللاحق الذي بدأه فريق الدكتور أحمد، اتضح أن التفعيل التعاوني للسيتوكينات الالتهابية بواسطة الدهون و TNF-α يتم بوساطة IRF3 (الرسم البياني ٣ و٤، أحمد وآخرون، ٢٠١٨).الكيموكينCCL2 (المعروف أيضًا باسم MCP-1) هو منظم رئيسي لتسلل الخلايا الأحادية إلى الأنسجة الدهنية، ويؤدي دورًا رئيسيًا في خصائص مرض الالتهاب المرتبط بالسمنة ومقاومة الأنسولين. أظهروا أن الخلايا الأحادية البشرية والخلايا البلعمية الكبيرة تنتج كمية هائلة من CCL2 في وجود TNF-α وبالميتات الأحماض الدهنية الحرة المشبعة (FFA)، وهو مكون رئيسي في النظم الغذائية عالية الدهون. ميكانيكيًا، لقد أثبتنا أن فرط إنتاج CCL2 TNF-α/بالميتات بوساطة يعتمد على IRF3. أظهرت فئران C57BL/ 6 التي تعاني من السمنة بسبب النظام الغذائي والتي لديها مستويات عالية من الأحماض الدهنية الحرة، وجود ارتباط قوي بين TNF-α و CCL2 في البلازما والأنسجة الدهنية. وكما هو متوقع، أظهرت أيضًا ارتفاعاً في نسبة تراكم الخلايا البلعمية في الأنسجة الدهنية مقارنة بالفئران غير السمينة. ولوحظت نتائج مماثلة في عينات الأنسجة الدهنية من البشر الذين يعانون من السمنة. بشكل عام، تدعم النتائج التي توصلنا إليها نموذجًا يُنشئ فيه ارتفاع الأحماض الدهنية الحرة في السمنة بيئة لـ TNF-α لتحفيز إنتاج CCL2 عبر سلسلة إشارات TLR4 / TRIF / IRF3 . ما يمثل مساهمة محتملة للأحماض الدهنية الحرة (مكونات النظام الغذائي عالية الدهون) في الالتهاب الأيضي.
توفر النتائج التي توصلنا إليها في هاتين الدراستين معلومات مهمّة بشأن السمات الوظيفية الرئيسية لـ IRF3 في تطوير الالتهاب الأيضي / السكري من النوع الثاني، ما قد يكون مفيداً لتطوير علاجات جديدة تعرقل مسارات الالتهاب المرتبطة بـ IRF3، وبالتالي تعزز الصحة الأيضية.
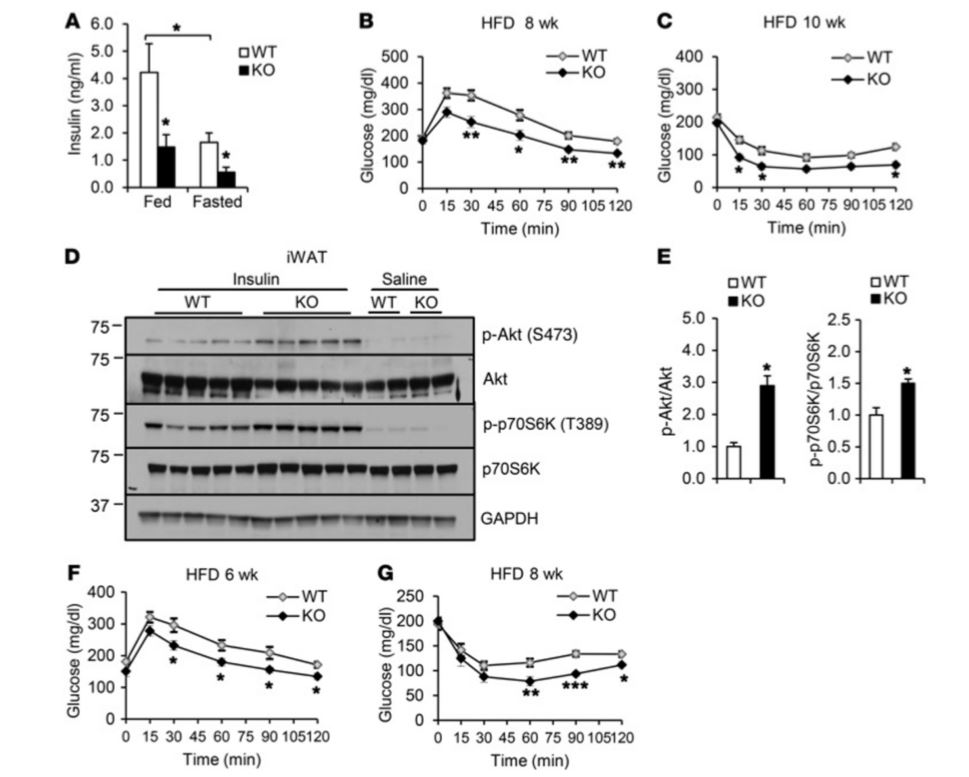
الرسم البياني 3 : تظهر فئران – / – Irf3 حساسية محسّنة للأنسولين عند اعتماد نظام غذائي غني بالدهون. (A) مستويات الأنسولين في البلازما المغذية والصائمة في الفئران البرية (WT) وفئران Irf3–/– بعد مرور 16 أسبوعًا على بدء نظام غذائي غني بالدهون (ن = 7-8 لكل نمط وراثي). (B) اختبار تحمل الجلوكوز بعد 8 أسابيع من بدء نظام غذائي غني بالدهون. (C) اختبار تحمل الأنسولين بعد 10 أسابيع من بدء نظام غذائي غني بالدهون. (D) فسفرة Akt و p70S6K المحفزة بالأنسولين في iWAT (الأنسجة الدهنية البيضاء الأربية) لفئران WT و Irf3–/– بعد مرور 16 أسبوعًا على بدء نظام غذائي غني بالدهون. (E) التحديد الكمي لويسترن بلوت في D (F) اختبار تحمل الجلوكوز لفئران WT و Irf3–/– عد مرور 6 أسابيع على بدء نظام غذائي غني بالدهون، قبل اختلاف الوزن. (F) اختبار تحمل الجلوكوز لفئران WT و Irf3–/– عد مرور 8 أسابيع على بدء نظام غذائي غني بالدهون، قبل اختلاف الوزن.
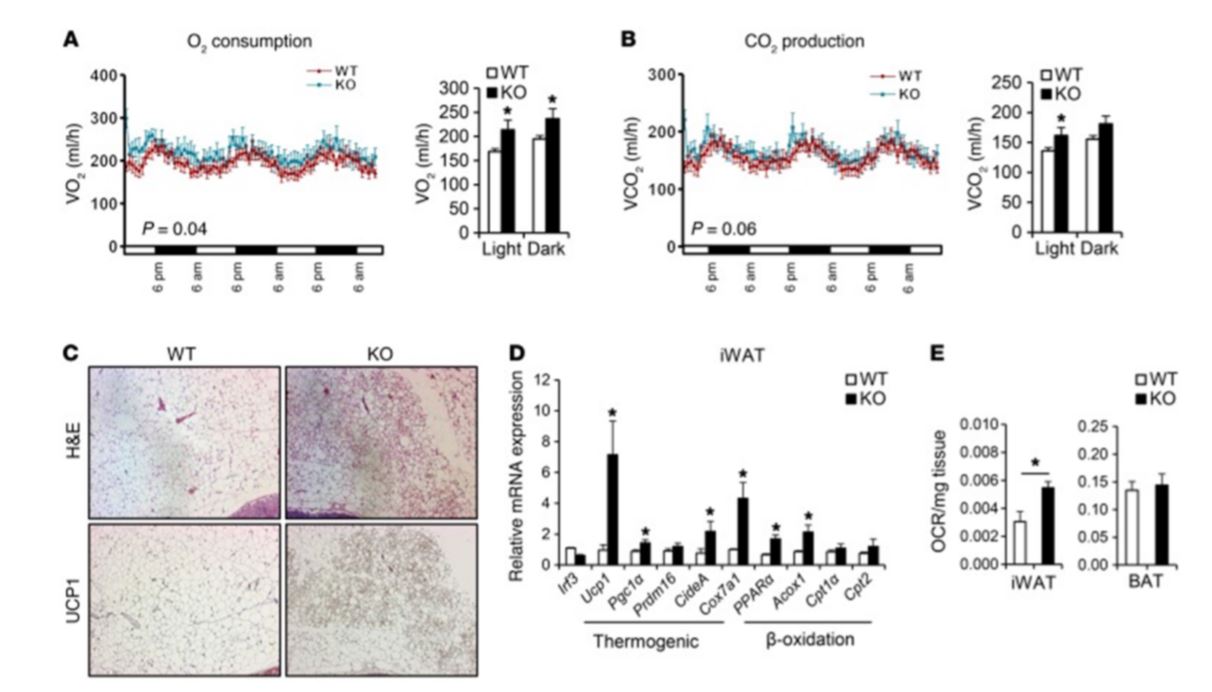
الرسم البياني 4: فئران Irf3 – / – تظهر زيادة في تحولّ الدهون البيضاء إلى دهون بنية. تم اعتمادلفئران ذكور WT و Irf3 – / – (ن = 7-8 فئران لكل مجموعة) نظاماً غذائياً غنياً بالدهون لمدة 16 أسبوعًا. (A & B) كمية الأكسجين المستهلكة. (A) كمية ثاني أكسيد الكربون المنتجة (ب) تم تحديد دورة الليل والنهار بواسطةCLAMS. (C) علم الأنسجة يظهر التلوين المناعي H&E و UCP1 في iWATلفئران WT و Irf3–/–تعتمد نظاماً غذائياً غنياً بالدهون. (D) التعبير عن الجينات الحرارية والأكسدة في iWAT فئران WT و Irf3–/–تعتمد نظاماً غذائياً غنياً بالدهون. (E) معدل استهلاك الأكسجين في iWAT والأنسجة الدهنية البنية لفئران WT وIrf3–/– التي تعتمد النظام الغذائي «تشاو».
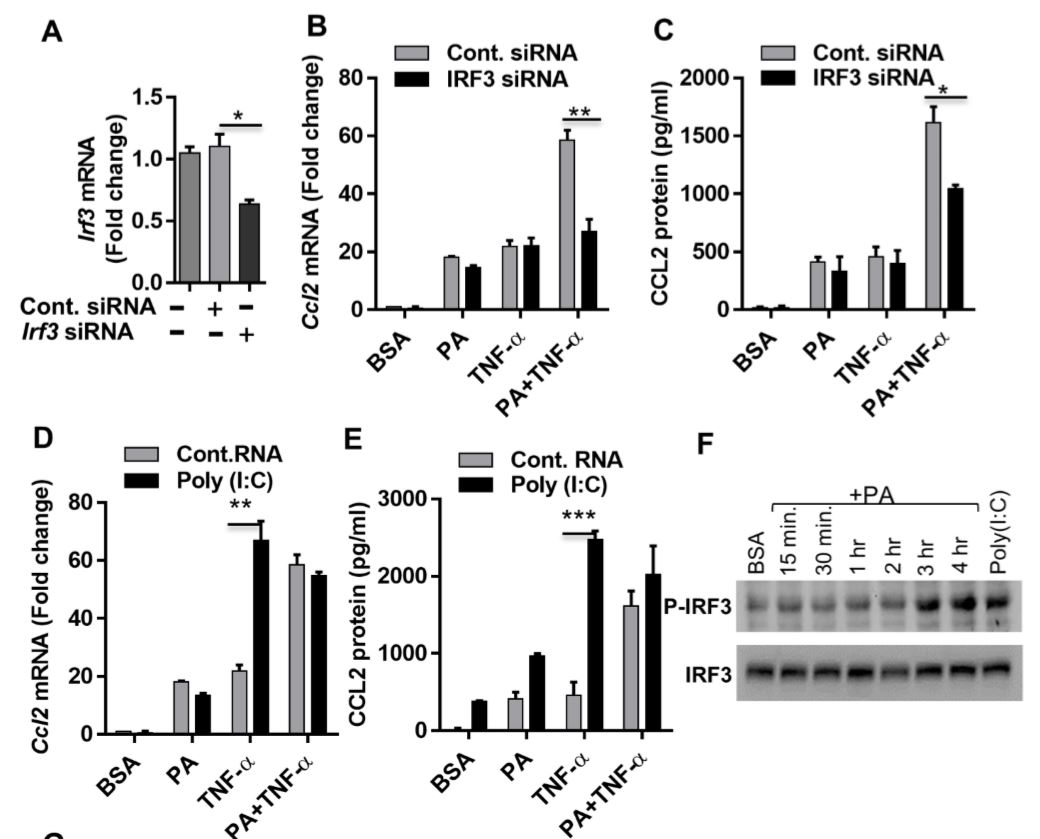
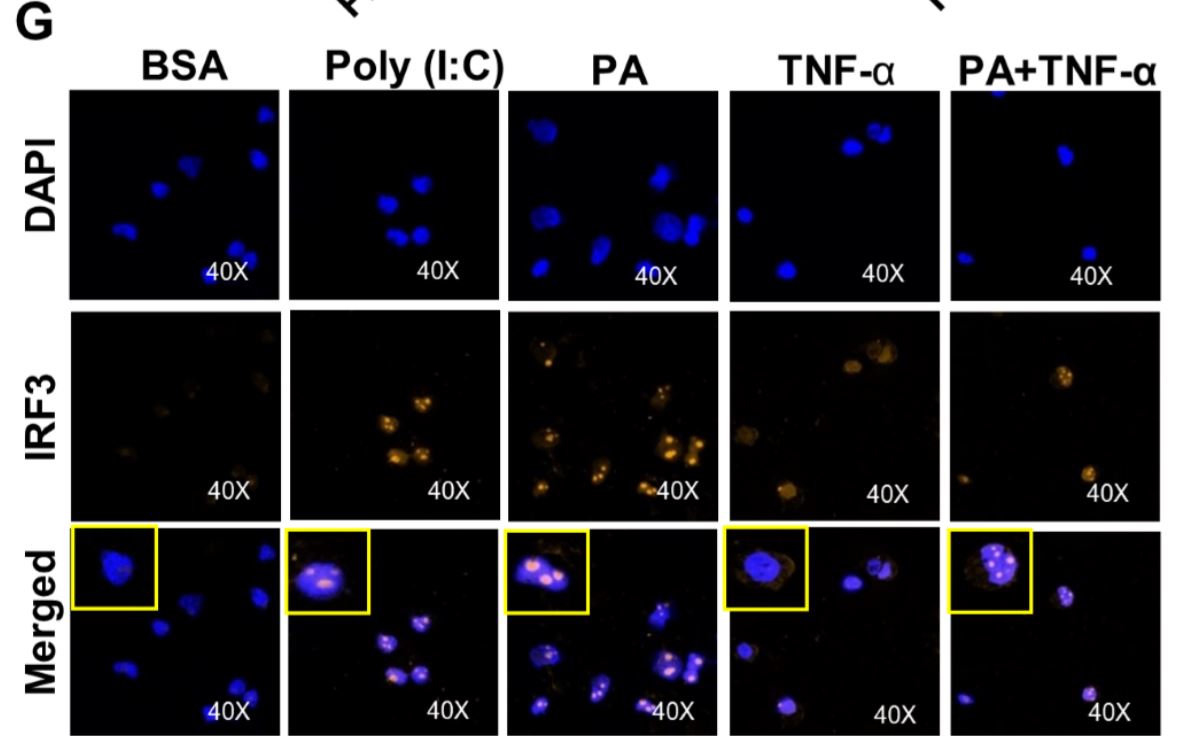
الرسم البياني 5: يتطلب الإنتاج التآزري لـ CCL2 بواسطة بالميتات / TNF-αالعامل التنظيمي للإنترفيرون 3. (A) تم تعداء الخلايا الأحادية عن طريق التحكم بها أو حمض نووي ريبوزي متداخل صغير (سيرنا) للعامل التنظيمي للإنترفيرون 3 واحتضانها لمدة 40 ساعة. تم إجراء تفاعل البوليميراز المتسلسل اللحظي لقياس تعبير العامل التنظيمي للإنترفيرون 3. (B & C) عولجت الخلايا التي تعاني من نقص في العامل التنظيمي للإنترفيرون 3 كما هو محدد، وتم تحديد تعبير البروتين والحمض النووي الريبوزي المرسال لـCCL2. (D&E) بوليينوسينيك: زاد حمض بوليسيتيديليك (منشط لعامل التنظيمي للإنترفيرون 3) CCL2 الناجم عن TNF-α. عولجت الخلايا (عن طريق التعداء) باستخدام بوليينوسينيك: حمض بوليسيتيديليك لمدة ساعتين، ثم حضنت باستخدام BSA أو PA أو TNF-α ، أو مزيج من PA و TNF-α لمدة 24 ساعة. (F) ويسترن بلوت تظهر فسفرة العامل التنظيمي للإنترفيرون 3 بعد معالجة PA أو بوليينوسينيك: حمض بوليسيتيديليك. (G) عولجت الخلايا كما هو محدد. تم تلوين الخلايا الثابتة والنفاذة للنواة والعامل التنظيمي للإنترفيرون 3 باستخدام «دابي» ومضاد IRF3 Ab. أظهر فحص الليزر بالمجهر البؤري توطين كيميائي مناعي للنواة (الأزرق، الألواح العلوية)، العامل التنظيمي للإنترفيرون 3 (الأحمر، الألواح الوسطى)، وصور مدمجة من النواة والعامل التنظيمي للإنترفيرون 3 مع إدخالات مكبرة (الألواح السفلية).
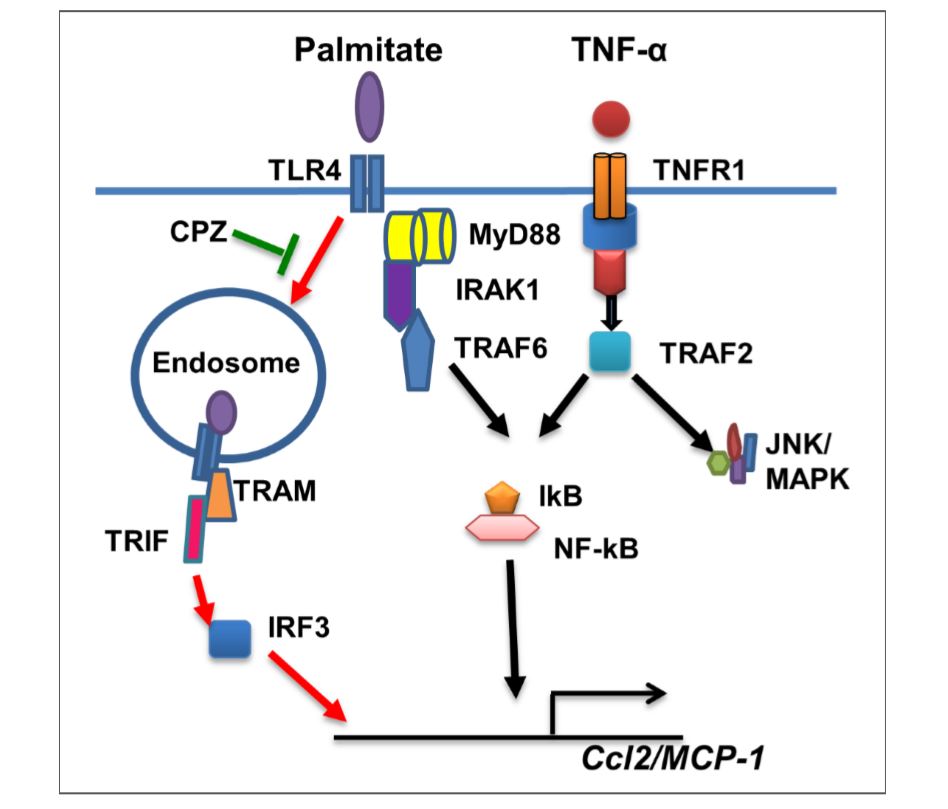
الرسم البياني 6: رسم توضيحي لمسارات الإشارات الكامنة وراء التآزر بين بالميتات و TNF-α لإنتاج CCL2. يمثل المسار المبرز بالسهام الحمراء الآلية السائدة لهذه الاستجابة التآزرية الناتجة عن بالميتات. قد يمنع كربوكسيببتيدازZاستيعاب بروتين TLR4ويثبط التآزر بين بالميتات / TNF-α لإنتاج CCL2.


